
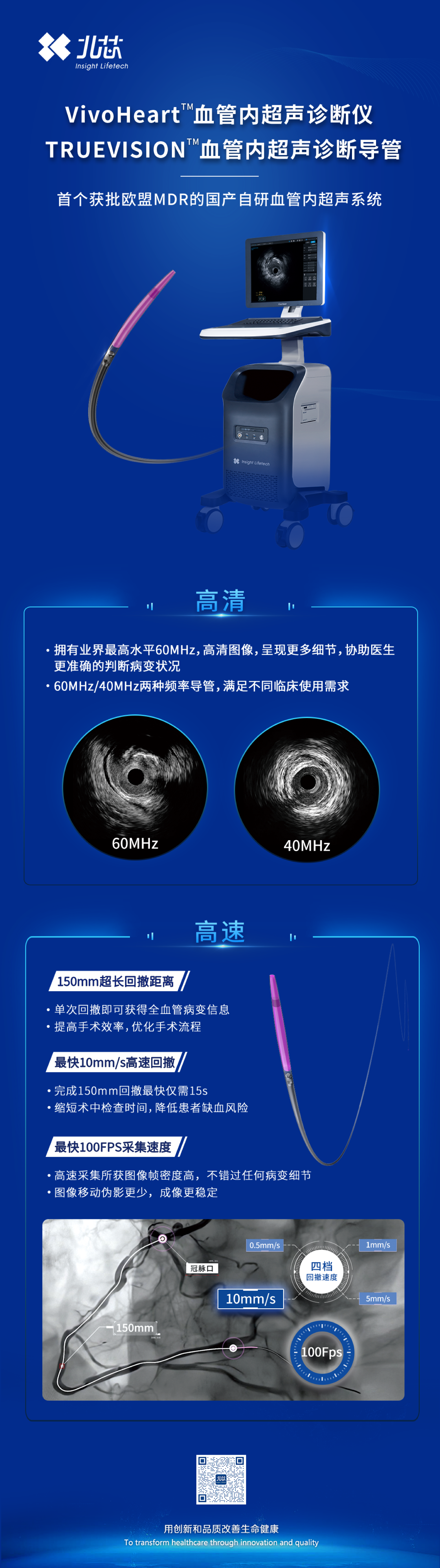
近日,由深圳北芯生命科技股份有限公司(以下简称“北芯生命”)自主研发的血管内超声(IVUS)主机VivoHeart™获得欧盟MDR IIb类医疗器械注册证,该产品是国内首个自主研发的60MHz高清高速IVUS产品,具有行业领先的成像速度。

此前,TRUEVISION™IVUS导管已于2024年3月获欧盟MDR III类医疗器械注册证,本次主机获批标志着北芯生命IVUS系统(由TRUEVISION™IVUS导管和VivoHeart™IVUS主机构成)成为首个获批欧盟MDR的国产自研IVUS系统。
宋亮博士--北芯创始人、董事长兼CEO
• 作为领航心血管精准介入解决方案的本土企业,北芯始终坚持以客户为中心、聚焦临床的真需求,持续创新研发、精益生产、卓越营销。此次IVUS系统获批欧盟MDR认证,标志着北芯继2020年3月血流储备分数(FFR)系统获批CE认证后,再度获得进入欧洲市场的通行证。随着北芯器械出口占比逐年提升,我们将继续推动中国智造高端医疗器械出海,让创新医疗科技惠及全球医患。
李林先生--北芯副总裁
• 北芯核心产品填补了领域内的国产空白并走上出海之路,包括国内首个获批准的金标准FFR系统、国内首个自主研发的60MHz高清高速IVUS系统等,在境内外取得十余张III类医疗器械注册证,获得境内外已授权发明专利60余项。期待北芯创新的IVUS产品未来能够高质量地服务欧洲等地区的医患。